问题描述:
天津“8.12“爆炸中扩散的CN-造成部分水体污染.某小组欲检测污水中CN-的浓度并模拟电化学法除去CN-.探究I 检测CN-浓度
资料:碱性条件下发生离子反应:2CN-+5H202+90H-═2CO32-+N2+6H20
实验装置如图1(其中加热、夹持装置省略).(不考虑污水中其它离子反应)
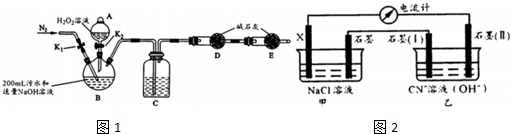
(1)加入药品之前的操作是___;C中试剂是___
(2)实验步骤如下:
| 步骤1 | 关闭K1,打开K2,滴入足量H2O2溶液,对B加热.充分反应后,停止加热 |
| 步骤2 | ___,用注射器穿过B装置的胶塞注入 ___溶液 |
| 步骤3 | 打开K1,通入N2 |
(4)为了使检测更加准确,上述(2)中操作要特别注意一些事项.请写出至少一条___.
探究Ⅱ电化学法处理CN-的影响因素由如图2装置模拟电化学法实验,有关结果如表.
| 实验序号 | 电极(X) | NaCl溶液浓度 (mol/L) | 甲中石墨表面通入气体 | 电流计读数 (A) |
| (1) | Fe | 0.1 | 空气 | I |
| (2) | Al | 0.1 | 空气 | 1.5I |
| (3) | Fe | 0.1 | O2 | 2I |
| (4) | Al | 0.5 | 空气 | 1.6I |
①X电极名称:___;
②实验(1)中X换成Zn,则电流计读数的范围为___
③若乙装置中阳极产生无毒无害物质,其电极方程式为___;该实验说明电化学法处理CN-,影响处理速率的因素有___(至少两条).
本实验是利用在碱性条件下双氧水将CN-氧化成碳酸根离子,再用稀硫酸与碳酸根反应生成二氧化碳,用碱石灰吸收生成的二氧化碳,根据装有碱石灰的干燥管的质量的变化确定二氧化碳的质量,根据碳元素守恒可计算出的物质...

