问题描述:
某化学兴趣小组用如图装置来完成制取较多量的饱和氯水和制漂白剂等实验.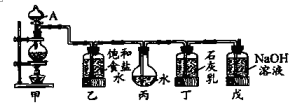
Ⅰ.(1)A仪器的名称:___.
(2)证明丙中制得的氯水已饱和的现象是___.
(3)丁中制漂白剂的离子方程式为___.
Ⅱ.某同学探究新制饱和氯水滴到红色布条上,发现红色布条褪色,对产生此现象的原因提出下列假设.
假设1:氯水中Cl2将有色物质氧化褪色
假设2:氯水中___(填化学式)将有色物质氧化褪色
为证明到底是哪种假设正确,该兴趣小组设计了如下实验:
(4)步骤3现象___;发生反应的离子方程式:___.
(5)下列措施可以让新制氯水漂白性增强的是___.(填字母)
A.高温蒸煮B.加AgNO3C.加CaCO3固体D.通入SO2
| 实验装置 | 实验现象 |
| 步骤1:将干燥的红布条投入到装有干燥氯气的集气瓶 | 发现有色布条不褪色 |
| 步骤2:将新制的饱和氨水等分成两份分装于A、B两试管 |  |
| 步骤3:向B中加入足量NaHCO3固体 |  |
| 步骤4:同时向A、B两试管加入相同大小的红布条,观察褪色的先后顺序 | B试管褪色所需时间短 |
Ⅰ.甲为气体发生装置,浓盐酸和二氧化锰在加热条件下反应生成氯气,乙用于除去HCl气体,丙用于吸收氯气,制备饱和氯水,氯气和石灰水反应生成氯化钙、次氯酸钙和水,戊为尾气吸收装置,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水
(1)A为分液漏斗,故答案为:分液漏斗;
(2)证明丙中制得的氯水已饱和,可观察到溶液陈黄绿色,且溶液上方有黄绿色气体,故答案为:液体及液体上方均呈黄绿色;
(3)氯气和石灰乳反应生成氯化钙、次氯酸钙和水,反应的离子方程式为Ca(OH)2+Cl2=Ca2++ClO-+Cl-+H2O,故答案为:Ca(OH)2+Cl2=Ca2++ClO-+Cl-+H2O;
Ⅱ.新制饱和氯水滴到红色布条上,发现红色布条褪色,可能原因是氯气具有漂白性,因氯气和水反应生成具有强氧化性的次氯酸,则也可能为次氯酸,
故答案为:HClO;
(4)向B中加入足量NaHCO3固体,因氯水中含有盐酸,可生成二氧化碳气体,促进氯气和水的反应,溶液颜色变浅,发生Cl2+HCO3-=HClO+Cl-+CO2↑,
故答案为:溶液变为无色,且有大量气泡产生;Cl2+HCO3-=HClO+Cl-+CO2↑;
(5)让新制氯水漂白性增强,可增大HClO浓度,但不能消耗HClO,高温促进气体挥发,二氧化硫具有还原性,加入硝酸银溶液和碳酸钙可以,因碳酸钙可盐酸反应,但与次氯酸不反应,加入硝酸银生成AgCl沉淀,使平衡正向移动,
故答案为:BC;
(6)步骤1:将干燥的红布条投入到装有干燥氯气的集气瓶,发现有色布条不褪色,说明干燥的氯气不具有漂白性;
步骤2:将新制的饱和氨水等分成两份分装于A、B两试管;
步骤3:向B中加入足量NaHCO3固体,因氯水中含有盐酸,可生成二氧化碳气体;
步骤4:同时向A、B两试管加入相同大小的红布条,观察褪色的先后顺序,可说明HClO具有漂白性.
由以上实验可知,假设2成立.有同学认为上述实验不够严谨,因步骤3中加入了NaHCO3,补充了一个实验:将同样大小的有色布条加入NaHCO3溶液,该同学做此实验的目的是为了证明NaHCO3不能使有色布条褪色,
故答案为:2;证明NaHCO3不能使有色布条褪色.

